

  |
|
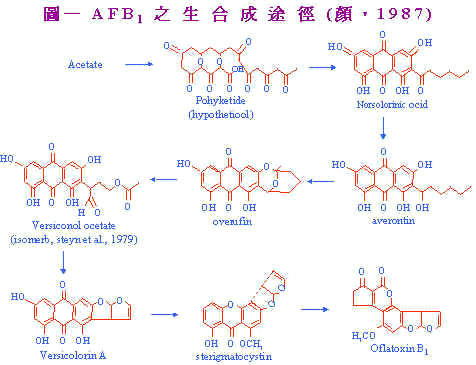
鄭永祥(1) 詹德芳(2) 吳繼芳(3) 一、前 言 台灣每年自美國進口大批穀物,其數高達818萬公噸(雜糧畜產,1990)穀物自收獲,船運、裝卸至製成飼料,往往耗時數月,期間之倉貯條件影響穀物之品質;且本省地處熱帶與亞熱帶,常年高溫多濕,極利於黴菌之繁衍。因此黴菌毒素污染也成為台灣養雞業及飼料製造業者所高度關注。 黃麴毒素(Aflatoxin)是由Aspergillus flavus及Aspergillus parasiticus所產生的黴菌毒素代謝產物,被認為具有潛在性的肝毒害(hepatoxin)及致癌物(carcinogen)。典型之黃麴毒素中毒症狀有嗜眠、垂翼、體溫上升和神經症狀。造成雞隻生長性能及飼料利用效率降低,胰臟消化酵素活性減低(Osborne et al., 1981),免疫能力減弱(Campbell et al., 1983;Chang et al., 1979),血液凝固延遲(Doerr et al., 1974),肝臟腫大及脂肪移動(mobilized)失調(Huff et al., 1986)等諸多毒害作用對畜禽業者造成莫大的經濟損失。 ───────────────────────────────────── (1)國立宜蘭農專畜產科 (2)國立中興大學畜產學系 (3)臺灣養豬科學研究所生產系統系 二、黃麴毒素之生合成 黃麴毒素為一族相似,自然存在之𨧤喃氧雜𤆥鄰酮類(furanocoumarins),這些化合物可在食物中黃綠色黴菌Aspergillus fravus及Aspergillus parasiticus之生長而發現,所有之黃麴毒素化合物均是具螢光性;可用長波長紫外線加以觀察。 黃麴毒素之生合成;已藉由利用1-C14或2-C14之acetate及methyl-C14 methionine之同位素追蹤方法研究其合扇途徑;並加以證實。圖一即為黃麴毒素B1之生合成徑路。利用能阻止AFB1形成之產黃麴毒素變異株及形成其一般代謝性之非產黃麴毒素菌種已可證明此生合成徑路中之各中間產物。例如,使用A. parasiticus變異株,得知averantin為AFB1之前驅物質,其位於averufin之前而在norsolorine之後。而versiconal acetate為AFB1之生合成主要中間物,versiconal acetate經酵素作用變成versicolorin A。sterigmatocystin為最後中間產物。 |
|
AFB1及AFG1之構造由Asao於1965年應用X-ray證實其為雙dihydrofuran環加以融合成順式(cis)構形。AFB1合成有不同之方式。AFB2及AFG2可由AFB1及AFG1之dihydrofuran環端還原而成。 Lee et al. (1974)發現在黃麴菌之基礎培養其中有鋅之存在時;其生長與產毒量均顯著增加,如表一。Gupt and Venk itasubramanian (1977)利用放射性元素研究黃麴毒素之合成。發現硫酸鋅濃度在10mM時產毒量最高。而植酸(phytic acid)則有抑制作用。此乃為何大豆污染黃麴毒素情形並不嚴重的原因;因大豆內含有植酸,鋅與植酸結合而失去作用所致。Gupta et al. (1976)指出當鋅存在時,hexokinase,G-6-P dehydrogenase,aldolase,puruvate kinase及glyceraldehyde-3-phosphate dehydrogenase等糖解酵素活性增高;合成黃麴毒素之前驅物因而增加。 |
| 表一 一 些 無 機 鹽 類 對 懸 浮 菌 絲 之 黃 麴 毒 素 比 活 性 影 響 | ||||||
| 添 加 化合物種類 | 黃 麴毒 素 | 添 加 的 濃 度 對 黃 麴 毒 素 比 活 性 改 變 的 % | ||||
| 0.01 | 0.10 | 0.50 | 1.0 | 10.0 | ||
|
硫 酸 鋅
硫 酸 鋅
氯 化 汞
氯 化 鋇
氯 化 鈣
氯 化 錳
|
B
G B G B G B G B G B G |
+3
-3 +9 +8 +21 +26 +27 +36 +7 +11 +2 -9 |
+10
0 +15 +14 +17 +17 +27 +37 +9 +15 -8 +13 |
+18
+3 - - -4 +12 +29 +35 +18 +21 +12 +7 |
+17
+4 +17 +15 -2 +9 +34 +30 +21 +27 +7 +9 |
+46
+33 +15 +14 - - +24 +27 +31 +29 +21 +30 |
|
(Gupta et al., 1976) |
||||||
|
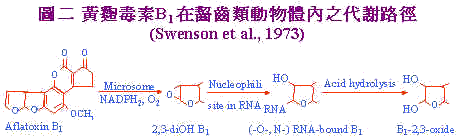
Maggon et al. (1977)指出黃麴菌開始生長時初級代謝即開始進行,此時僅有少量之黃麴毒素:後因磷、氮等初級代謝中所需之養分用罄;生長逐漸受阻,初級代謝物於是累積,如pyruvate,malonate,acetate和各種胺基酸代謝物;引發次級代謝所需之酵素活性,次級代謝作用於焉開始,此時polyketide生合成代謝路徑(polyketide biosynthetic pathway)超過脂肪酸的生合成代謝;促進aflatoxin的生合成。 三、黃麴毒素之生體內代謝 黃麴毒素在體內之分解代謝路徑可分為徑路一和徑路二。徑路一主要為齧齒類動物(rodents)體內之代謝,如圖二 。 |
|
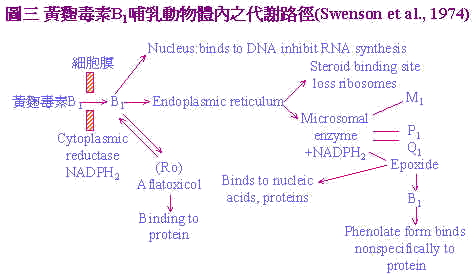
黃麴毒素B1經由飼料進入體內,到達肝臟之微粒體(Microsome)在NADH2及O2存在下氧化為B1-2,3 oxide,此化合物具有高度之親核性(nucleophilic)會攻擊RNA與RNA中之-0-或N-group形成RNA bound B1之產物,再經由酸性水解(Acid hydrolysis)過程轉變成毒性較低之2,3-dioHB1。 徑路二:主要發生於哺乳類動物:如圖3。Aflatoxin B1經由哺乳動物攝入後;通過細胞膜進入細胞,在細胞質還原鋛(cytoplasmic reductase)作用下NADPH2輔助還原為Aflatxicol (Ro)再與蛋白質結合。或進入核仁與DNA鍵結,繼而抑制RNA的合成或經過細胞質中的內質網在微粒體鋛作用及NADPH2存在下代謝成生毒性較弱之AFM1及無毒性AFP1及毒性較強之AFQ1,和最具毒性的Aflatoxin epoxide,此一衍生物可與核酸及蛋白質結合。或epoxide經再代謝成AFB2以石碳酸鹽形成與蛋白質呈非特異性的結合。 |
|
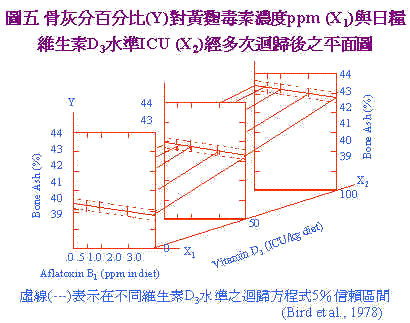
黃麴毒素的影響;對細胞不同層次的作用不一,它對蛋白質形成顯然具有抑制作用,因為它與DNA結合阻礙RNA的合成,甚至於所有蛋白質的合成,從轉錄(transcription)、轉譯(translation)、直到加長(elongation)各步驟都會發生影響。不過當動物吸收多量及長期暴露在黃麴毒素情形下;影響最鉅的是轉錄過程受抑制,碳水化合物及脂質的代謝以及粒線體呼吸作用的改變。且黃麴毒素與大分子(核酸與蛋白質等)與細胞微器官(粒線體與核醣體)之間又有交互作用,並干擾酵素及其他細胞調節物質(cellular regulators)。 四、黃麴毒素對營養分吸收代謝之影響: 黃麴毒素最主要之標的器官為肝臟;肝臟將之代謝為2.3-oxide,此一代謝具強烈之肝毒性。因肝臟壞死及干擾肝臟正常功能,膽汁產生減少及胰臟酵素分泌減少,致對營養分的吸收不良。此外;本節也將討論飼料中孟寧素monensin與單寧對黃麴毒素的交互作用。 孟寧素為一種streptomyces cinnamonesis所產生的代謝物,用以控制球蟲病的發生;雞隻被球蟲攻擊後,日糧中孟寧素與黃麴毒素同時存在所導致的盲腸病變(cecal lesion)異於單純球蟲感染者,造成田間診斷雞隻病變上的困擾。日糧中單寧含量一般之許可限量為2%以下,但此一濃度下之單寧與黃麴毒素存在具加成性的毒性產生。 (一)黃麴毒素與單寧、monensin的交互作用 Dale et al. (1980)連續使用兩個試驗來探討單寧與黃麴毒素的關係。試驗一使用試葯級單寧來源,試驗二則以BR-64品種之高梁來供應單寧,結果如日糧中含0.5%及1.0%單寧和2.5ppm黃麴毒素時;體重顯著下降,飼料換肉率(FCR)亦變差,顯示單寧與黃麴毒素有加成性毒害作用。 Tamir and Alumot (1970)指出,單寧與蛋白質在胃腸內形成不溶物,且Osborne et al. (1976)發現黃麴毒素造成胰臟之解脂鋛,澱粉鋛,胰蛋白鋛活性下降,推斷可能由此兩種原因加成所致。 Wyatt et al. (1975)探討日糧中之黃麴毒素及孟寧素時,再以球蟲(E. tenella)卵囊接種後;計算6日內之雞隻死亡率,日糧含孟寧素組死亡率為10%;當添加黃麴毒素時提高至30%;此時若無孟寧素添加則死亡率高達60%。故黃麴毒素與球蟲症具有協同增加雞隻死亡率之作用。此外,病理學判定上,兩者同時存在時其病變記分(lesion score)較單獨以球蟲感染之病變記分為低,病變記分是以盲腸中凝血塊及盲腸擴張程度而定。Doerr et al. (1974)指出aflatoxin干擾血凝,特別是外源性和一般血凝途徑,可能因此造成凝血慢且盲腸較不呈擴張的外觀如圖4。(A)為只感染E. tenella可見盲腸凝血及擴張;(B)為E. tenella+2.5ppm黃麴毒可見盲腸內凝血少且擴張小。此一特殊病變,在田間常被誤判為非球蟲感染引起之死亡。 (二)aflatoxin對膽沈鈣化固醇、碳水化物代謝及鐵吸收的影響 Bird et al. (1978)指出,aflatoxin含阻礙VitD3在體內之代謝;是因肝臟破壞後;產生之25-hydroxylase減少所致,同時脛骨中灰分量減少,資料經複迴歸方程式(multiple regression equation)導出一公式: Y=40.44962-0.27464X1+0.03197X2 X1:為AFB1的ppm X2:為VitD3 ICU 圖5為迴歸平面圖,圖中可知黃麴毒素提高,骨灰分減少,VitD3增加,骨灰分增加。由方程式計算知日糧中含1ppm AFB1時,須額外增加8.84 ICU VitD3方可使骨中灰分維持不變。 |
| 體內之碳水化合物代謝亦變黃麴毒素影響。Raj et al (1970)的研究發現;黃麴毒素會造成雞隻肝醣生成量減少,肝臟無法迅速將葡萄糖轉為肝醣,故其葡萄糖耐性減低。另外在碳水化合物代謝過程中相當重要的醣解作用(glycolysis),醣解作用主在雞肝臟及肌肉中進行以產生高能化合物(ATP)供能量所需。黃麴毒素降低醣解過程中幾個重要之速率決定酵素(key enzyme)如hexokinase,phosphoglucoisomerase,fructosediphosphate aldolase,pyruvate kinase等醣素活性;如表2所示。可見黃麴毒素症爆發時;雞隻無法藉由醣解來產生能量;但糖質新生(Gluconeogenesis)過程中重要之key enzyme,pyruvate carboxylase及PEP carboxykinase活性顯著地升高。故雞隻對能量來源轉而由胺基酸代謝供應,如表3所示。 |
| 表二 黃 麴 毒 素 B1 對 雞 肝 中 某 些 醣 解 酵 素 的 影 響 | |||
| Enzyme activity | Control | Treated | P value |
| Hexokinase
Units/g liver Specific activity Phosphoglucoisomerase Units/g liver Specific activity Fructosediphosphate aldolase Units/g liver Specific activity Pyruvcate kinase Units/g liver Specific activity Lactate dehydrogenase Units/g liver Units/g protein |
2.30±0.16 19.22±1.41
145.90±4.77 810.0±20.30
5.97±0.19 52.33±1.75
6.88±1.33 2.67±0.40
188.4±20.0 141.7±31.0 |
0.56±0.04 6.09±0.52
69.40±1.53 680.0±19.5
3.27±0.05 34.77±1.77
61.00±2.16 24.20±0.82
1.570±2.00 0.540±190 |
0.001 0.01
0.05 0.05
0.001 0.001
0.001 0.001
N.S N.SU |
| 比活性以units/g蛋白質表示,每一數值是6隻雞之平均±標準機率差,P≦0.05表示顯著差異。N.S.代表無顯著差異。 (Raj et al., 1974) | |||
|
表三 黃 麴 毒 素 B1 雞 肝 中 fructose-1,6-diphosphatase , pyruvate carboxylase 和 phosphoenol pyruvate carboxykinase 之 影 響 |
|||
| Enzume assayedy | Control | Treated | P value |
| Fructosediphosphatase
Units/g liver Specific activity Pyruvate carboxylase Units/g liver Specific actuvity PEP carboxykinase Units/g liver Specific activity |
11.15±0.46 92.42±3.18
275.0±56.83 5,220±240
2.4×105 21×105 |
12.35±2.50 93.31±3.61
688.0±21.67 31,730±1,380
4.4×105 47×105 |
N.S. N.S.
0.001 0.001
0.001 0.001 |
| Specific activity is experssed as units/g protein. Each value is the mean±S.E. for 6 birds. P≦0.05 is considered significant. N.S. means not significant. (Raj et al., 1974) | |||
|
黃麴毒素中毒所造成之貧血,先前之研究(ForgacsCarel, 1962)認為是形成不全性貧血(aplastic)。Tung et al. (1975)及Smith et al. (1970)均指出隨aflatoxin劑量之提高血球容積比(PCV)隨之下降。Tung et al. (1975)認為是溶血性貧血(hemolysis)。Lanza et al (1979)應用同位素59Fe餵與白肉雞探討aflatoxin對PCV的影響,結果0~3wks齡黃麴毒素處理組之PCV,顯著較低;3~6wks齡時卻無此現象出現;此與Lanza et al. (1978)發現隨週齡增加;aflatoxin所造成之貧血反應較不敏感。試驗中也發現Fe的主動運輸減少;主動運輸需要transferrin的媒介;transferrin由肝臟所製造;肝臟壞死情形下鐵運輸即因transferrin之減少而下降,因而有PCV低及貧血現象產生。 五、黃麴毒素引發白鳥症之機制: 黃麴毒素毒性試驗中發現會降低血中的胡蘿蔔素(hypocarotenoidmia),引起白鳥症(pale bird syndrome)。白鳥症之雞隻可視粘膜,如眼瞼、冠、瞬膜、皮膚、腳脛之色素褪除(depletiom);顯現出蒼白外觀。然除黃麴毒素會引起外,其他如赭黃毒素(Ochratoxin)、球蟲感染、里奧病毒(Reovirus)和日糧不平衡均會發生。本節乃討論黃麴毒素誘發白鳥症之機轉。 Osborne et al. (1982)以各種黴菌毒素(T2-toxin, aflatoxin, Ochratoxin)餵予白肉雞發現有低胡蘿蔔血症;因此認為aflatoxin可能導致白鳥症之發生。因對carotenoids的吸收及沈積機構瞭解甚少,一般咸認為其伴隨脂肪被消化吸收及代謝。Tyczkowski et al. (1986a)試驗指出雞對玉米黃素(cryptoxamthin)吸收差,以其為參考值,比較zeacarotene/cryptoxanthine及lutein/cryptoxanthine之比。在各段腸道消失之位置。結果得知zeacarotene和葉黃素(lutein)吸收部位不同,前者主在十二指腸及空腸,後者則為迴腸中後段,如圖6。 |
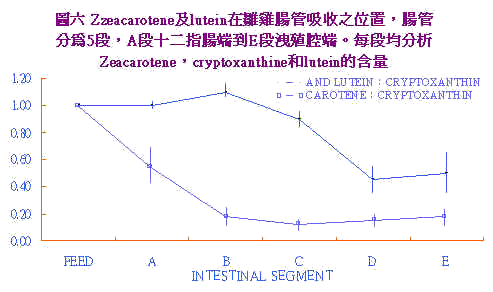
|
Tyczkowski et al. (1986b)在探討葉黃素於體內運輸,代謝及沈積型式時,指出lutein diester進入雞體內後,於腸中進行去醯基化(deacylation)後以lutein及單酯(lutein monoester)形式進入血中,肝臟所堆積之型式為游離葉黃素(free lutein)佔88%,腳蹼部份主要為lutein diesten及monoester。如圖7及表4所示。
|
| 表五 各 種 型 態 葉 黃 素 在 體 內 之 分 布 情 形 | |||
| 部 份 | Lutein diester | Lutein monoester | Free lutein |
| 空腸黏膜
血 清 肝 臟 腳 蹼 |
少量
少量 6% 66% |
6%
1% 6% 8% |
94%
99% 88% 26% |
|
Tyczkowski et al. (1987)證實aflatoxin使得lutein diester吸收大為減少,且影響各部份中lutein之型式,遂有白鳥症之產生。Schaeffer et al. (1988a)即利用葯物動力學方法(pharmacokinetic method)探究表皮中lutein酯化沉積的速率。以K1,K2,K3,代表速率常數: 血清中游離葉黃素→K1→表皮 中游離態葉黃素→ K2→表皮中單酯葉黃素→K3→表皮中雙酯葉黃素 結果顯示經黃麴毒素處理後K2,K3值降低,顯示表皮之醯化(acylatien)對黃麴毒素相當敏感,但是K1不被影響。由於肝臟中之主要為游離態之葉黃素;但黃麴毒素致使肝臟中主要為酯化型態使待運送到表皮的Lutein無法進行。如表5以上所知均為對Lutein蓄積的抑制;是否黃麴毒素亦會加速色素在體內之褪除;Schaeffer et al. (1988b)研究顯示黃麴毒素對空腸中、血清中及腳蹼中色素褪除均無影響。葯物動力學研究亦顯示,黃麴毒素對K1,K2及K3值之模式型態(K1最慢,K2次之,K3最慢)與對照組相同。如表6所示。 |
| 表五 黃麴毒素對表皮色素沈積反應之速率常數的影響 | ||
| Rate速率A | Control | Aflatoxin B |
| ──────── (day -1) ──────── | ||
| K1
K2 K3 |
2.51×10-1±0.03a
2.65×10-1±0.01a 0.83×10-1±0.01a |
2.08±10-1±0.03a
0.05×10-1±0.01b 2.15×10-1±0.01b |
| a,b同一行中有不同上標者表顯著差異(p<0.05)
A 速率常數的代號:K1=Lutein的形成;K2=lutein monoester的形成K3=lutein diester的形成 B 日糧中含2ppm之黃麴毒素 (Schaeffer et al., 1988a) |
||
| 表六 黃麴毒素對表皮色素褪除反應之速率常數的影響 | ||
| Constant | Control | Aflatoxin AB |
| ────── (day -1) ────── | ||
|
K1(Diester→monoester) K2(Monoester→lutein) K3(Lutrin→serum lutein) |
7.4×10-2±0.006a
3.6×10-2±0.15b 2.4×10-1±0.01c |
6.3±10-2±0.008a
4.2×10-2±0.1a 2.3×10-1±0.01b |
| a-b同一中有不同上標者表顯著差異(P<0.05)
A 日糧中含4ppm之黃麴毒素 B 對照組之各別速率常數與相關之黃麴毒素處理組速率常數比較,顯示無顯著差異。 (Schaeffer et al., 1988a) |
||
|
Day et al. (1958)指出,日糧中添加5%牛油可增加色素沈積,Health et al. (1972)於日糧潻加大豆油時可刺激oxycarotenoid在背部皮膚之蓄積。 Han et al. (1987)餵予玉米變異種,含高量油可刺激腳脛和血漿色素沈著。 Schaeffer et al (1990)指出,日糧中脂肪含量增加,血清中lutein及lutein代謝物3-oxolutein均增加且於6%脂肪添加時達到最高。如表7所示日糧中含有aflatoxin時亦有相同之結果。顯示脂肪增加可促進lutein溶於脂肪及乳糜微粒(micelle)之形成。 |
| 表七 日糧添加各種水準脂肪對黃麴毒素症雞隻之血清oxycarotenoids的影響 | ||||
| Fat dietA % | 3-OxoluteinB | LuteinB | ||
| - | + | - | + | |
| 0
2 4 6 8 10 |
0.36±0.06d
1.09±0.03c 1.56±0.05b 1.84±0.07a 1.77±0.06a 1.75±0.01a |
0.08±0.01b
0.28±0.05b 0.46±0.08b 0.91±0.16a 0.92±0.13a 1.00±0.19a |
5.5±4e
17.1±0.4d 24.1±.1.2c 32.0±.1.2a 28.6±0.6ab 27.1±.1.4bc |
0.7±0.1c
3.0±0.3b 5.7±0.12b 11.1±.1.8a 10.8±.1.2a 14.3±.4a |
| a-b
同一列中有不有同上標者表顯著差異(P<0.05)。
A 雞隻餵予的白玉米黃豆粉和澱粉再水準之棉子油的基礎日糧3週後。一組中10隻雞平均濃度+SE的值。 B +或-代表有或無1.4ppm黃麴毒素之添加。 (Schaeffer et al., 1990) |
||||
|
脂肪來源中富含飽和短鏈脂酸(如capric acid C10:0;lauric acid C12:0)對於因黃麴毒素而造成lutein吸收下降具有拮抗效果;而長鏈不飽和脂酸效果較飽和短鏈者為差。黃麴毒素因降低雞隻對脂肪消化過程中形成乳糜微粒之能力,是以micelles形成減少。故有Osborne和Hamilton (1981)所觀察到之脂肪痢現象產生。 脂肪水準高時,lutein吸收增加,反應出oxycartenoids吸收須脂肪來溶解,並形成micelles再將oxycarotonoids運入腸細胞。 黃麴毒素劇烈的降低血清中脂質含量(Fung et al., 1970)故亦可能降低內源性脂肪和單酸甘油酯在膽汁中形成的量。在日糧脂肪缺乏時,內源性的疏水性及親水性脂質之形成相形減少,僅能提供有限度的micelles形成及有限的日糧oxycarotenoids的運輸。 而日糧中提高脂肪對黃麴毒素的毒害有抵抗的效果,乃增加本來就有限的疏水性及親水性脂質(受黃麴毒素而減少者);且短鏈飽和脂酸可作為形成micelle中心之疏水端,較佳於其他種類脂酸。 六、結 論 1.黃麴毒素為Aspergillu flavus與Aspergillus parasiticus利用醋酸鹽作為基質,經Polyketide生合成代謝路徑,所合成之次級代謝產物;在合成過程中鋅離子與產毒素量具有密切之關係;可能為其中間代謝酵素之輔因子;黃麴毒素較重要的有B1、B2、G1、G2;其中以黃麴毒素B1之毒性最強;危害亦最大。 2.黃麴毒素進入物體內有兩種不同之代謝徑路。分別為發生於齧齒類動物及哺乳類動物之肝臟;黃麴毒素B1經代謝為毒性極強之黃麴毒素epoxide再與核酸和蛋白質結合,並干擾DNA的轉錄、轉譯過程。故具可導致突變、致畸胎與致癌性。 3.黃麴毒素造成肝壞死、肝細胞退化、膽小管上皮細胞增生,膽汁產生減少及胰臟酵素分泌變少,故影響到動物體對營養分之吸收和代謝。如阻礙維生素D3在體內之代謝;葡萄糖耐性減強;鐵吸收減少等。 4.白鳥症的發生乃因黃麴毒素影響葉黃素(lutein)在腸管之運輸和醯基化使之與正常之代謝過程不同;使得lutein diester和monoester均沈積於肝臟中無法生去醯基化成free lutein運輸至表皮表腳脛中沈積。 但對於色素之褪除;黃麴毒素則無影響。藉由日糧中提供含飽和短鏈脂酸和不飽和長鏈脂酸時;可提高葉黃素之吸收;對黃麴毒素之阻礙吸收作用有節約效果(sparing effect)。 七、引用文獻 1.雜糧與畜產月刊。12月。1990。 2.世界玉米黃麴毒素研究專輯。1990。台灣區雜糧發展基金會。 3.林茂勇。1991。黴菌毒素學。淑馨出版社。 4.顏國欽。1980。食品安全學。藝軒出版社。 5.Mycotoxins in human and animal health;Aflotoxin p8-98. 1977. Pathotox publisher. inc. 6.Aso, T. et al. 1970. J. Am. Chem. Soc., 85:1706-1707. 7.Bird, F. S. et al. 1978. Poult. Sci., 57:1293-1296. 8.Campbell, M. L. et al. 1983. Poult. Sci., 62:2138-2144. 9.Chang. C. F. et al. 1979. Poult. Sci., 58:562-566. 10.Dalle, N. M. et al. 1980. Poult Sci 69:2417-2420. 11.Day, E. J. et al. 1958. Poult. Sci., 37:1373-1381. 12.Doerr. J. A. et al. 1974. Poult. Sci., 53:1728-1734. 13.Forgacs, J. et al. 1962. Adv. Vet. Sci., 7:273-382. 14.Gupta, S. K. et al. 1976. Appl. Enviro. Microl., 32:324. 15.Gupta and Venkitabramanian. 1977. Microbiol. 18:27-34. 16.Han, Y. C. M. et al. 1987. poult. Sic., 66:103-111. 17.Heath, J. J. et al. 1972. Poult. Sci., 51:502-506. 18.Huff, W. E. et al. 1986. Poult Sci., 65:1891-1899. 19.Lanza, G. M. et al. 1978. Poult. Sci., 59:282-288. 20.Lanza, G. M. et al. 1979. Poult. Sci., 59:1439-1444. 21.Lee, L. S. et al. 1974. J. Assoc. Off, Anal., 57:626-631. 22.Maggon, K. K. et al. 1977. Bacteriol. Rev., 41:822-855. 23.Osborne, D. J. et al. 1976. Poult. Sci., 54:1802. 24.Osborne and Hamilton. 1981. Poult. Sci., 60:1398-1402. 25.Osborne and Hamilton. 1982. Poult. Sci., 61:1646-1652. 27.Raj, H. G. et al. 1974. Environ. Phisiol. Biochem., 4:181-187. 28.Schaeffer, J. L. et al. 1988. Poult. Sci., 67:1080-1088. 29.Schaeffer, J. L. et al. 1988. Poult. Sci., 67:619-625. 30.Schaeffer, J. L. et al. 1990. Poult. Sci., 69:53-59. 31.Smith, J. W. et al. 1970. Poult. Sci., 49:207-215. 32.Swenson, D. H. et al. 1973. Biochem. Biophys. Res. Commun., 53:1260-1267. 33.Swenson, D. H. et al. 1973. Biochem. Biophys. Res. Commun., 60:1036-1043. 34.Tamir, M. et al. 1970. J. Nutr., 100:573-580. 35.Tung, H. T. et al. 1972. Appl. Pharmacol., 22:27-104. 36.Tung, H. T. et al. 1975. Poult. Sci., 54:1962-1969. 37.Tyckowski, J. K. et al. 1991. Poult. Sci., 70:2275-2279. 38.Tyckowski, J. K. et al. 1986a. Poult. Sci., 65:1526-1531. 39.Tyckowski, J. K. et al. 1986b. Poult. Sci., 66:1184-1188. 40.Wyatt, R. D. et al. 1975. Poult. Sci., 54:1065-1070. |